Encephalitozoonose beim Kaninchen
Als „Encephalitozoonose“ wird eine Krankheit beschrieben, die durch den Erreger
„Encephalitozoon cuniculi“ (EC) hervorgerufen wird. Dieser parasitische Einzeller lebt
obligat intrazellulär in der Niere, dem Gehirn und anderen Organen, die gut durchblutet
werden. Das Wort „encephalo“ bedeutet im Griechischen das Gehirn, „Zoonose“
bezeichnet eine Erkrankung, die vom Tier auf den Menschen übertragen werden kann.
Synonym wird gelegentlich der Begriff „Torticollis“ benutzt, der eigentlich ein mögliches
Symptom, den „Schiefhals“ bzw. einen zwanghaft verdrehten Kopf beschreibt. Im
Englischen steht „Head tilt“ sinngemäß für das gleiche Symptom.
Die erste Beschreibung der Erkrankung geht auf Wright & Craighead, 1922 zurück, die
an Kaninchen und Meerschweinchen Versuche zur Verbreitung der Kinderlähmung u.
a. mit Flöhen, die von Ratten übertragen werden, unternahmen. Diese schlugen fehl,
aber zufällig wurde dabei eine Krankheit bei Kaninchen festgestellt, die Lähmungen
verursachte, welche im Zusammenhang mit einem bestimmten Organismus mit
eindeutigen Merkmalen standen. Dieser Organismus fand sich weit verteilt in den
Organen der betroffenen Tiere und konnte auch im Urin nachgewiesen werden.
Besonders auffällig war die aktive Zerstörung der Nervenzellen des Rückenmarks
durch den Erreger, die eine vollständige Erklärung für die klinisch beobachtete
Lähmung lieferte. Da der Organismus im Urin der Tiere nachgewiesen wurde, war die
Ausbreitung der Krankheit durch oralen Kontakt leicht zu verstehen. Als Erreger wurde
ein protozoischer (einzelliger) Parasit vermutet.
Ein Jahr später wurde von dem Autorenkollektiv Levaditi, Nicolau und Schoen, 1923
der Name „Encephalitozoon cuniculi“ (E. cuniculi) für den Erreger vorgeschlagen,
wobei auch sie noch nicht sicher waren, ob es sich um eine Bakterie oder einen
Parasiten handelte. Zwischenzeitlich erfolgte eine Umbenennung in „Nosema cuniculi“,
die aber wieder rückgängig gemacht wurde.
Bild 1: Taxonomie der Mikrosporidia; nach Sieg, 2014
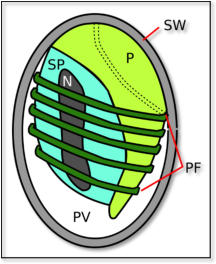
Bild 2: Aufbau einer E. cuniculi-Spore; nach Sieg, 2014; N=Nukleus; P=Polarplast;
PF=Polfilament (Polrohr); PV=posteriore Vakuole; SP=Sporenplasma;
SW=Sporenwand
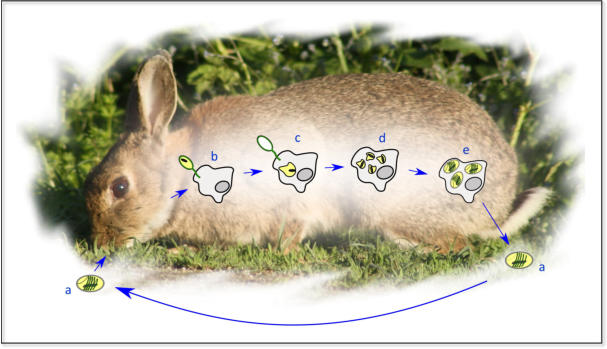
E. cuniculi wird durch eine kleine dickwandige Spore
repräsentiert, die ein typisches Invasionssystem
beherbergt. Die raketenartig aktivierte Spore stößt ein
längliches Element, das sogenannte Polrohr
(Polfilament), aus, durch welches das infektiöse
Sporoplasma inklusive Zellkern in eine Zielzelle injiziert
werden kann. Anschließend erfolgt eine schnelle
Vermehrungsphase (Merogonie) durch binäre
Spaltung. Es folgt eine Reifungsphase (Sporogonie), in
der Sporonten mit verdickter Hülle gebildet werden, die
sich in Sporoblasten teilen und dann zu Sporen
entwickeln (Vivarès & Méténier, 2001). Die Sporen
werden mit dem Urin ausgeschieden und von Tieren
über Nahrung aufgenommen, welche durch Urin kontaminiert ist.
Bild 3: Lebenszyklus von E. cuniculi; nach Keeling & McFadden, 1998; Stadien: a-
c=Infektionsphase; d=Vermehrung (Merogonie); e=Reifung (Sporogonie)
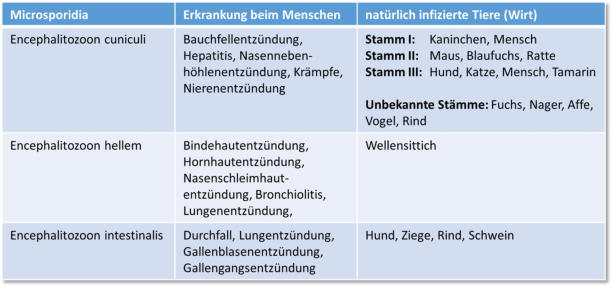
Der Parasit verursacht Infektionen bei Säugetieren, einschließlich dem Menschen und
bei Vögeln. In der folgenden Tabelle sind die drei bekannten Encephalitozoon-Erreger
mit ihren natürlichen Wirten und möglichen Erkrankungen aufgeführt. Von E. cuniculi
wurden bisher 3 verschiedene Stämme isoliert.
Tabelle 1: Encephalitozoon-Erreger und mögliche Erkrankungen, nach Didier et al,
2012
Übertragung
Eine Untersuchung in einer Kaninchenzuchtkolonie von Cox et al., 1977 über einen
Zeitraum von 9 Monaten zeigte, dass alle 9 Wochen alten Kaninchen mit einer E.-
cuniculi-Infektion von Häsinnen geboren wurden, die mit dem Parasiten infiziert waren.
Das heißt, dass die Infektion junger Kaninchen stark mit der Infektion der Häsinnen,
aber nicht mit der von Rammlern zusammenhing. Diese Beobachtung, die aus
Untersuchungen an 395 jungen Kaninchen gewonnen wurde, deutete darauf hin, dass
die Übertragung der Infektion entweder transplazentar erfolgte (vertikale Übertragung)
oder das Ergebnis eines engen Kontakts kurz nach der Geburt war (horizontale
Übertragung). Auf dieser Grundlage wurden 16 junge gesunde Kaninchen, die
seronegativ für E. cuniculi waren, isoliert und in 2-wöchigen Abständen auf Antikörper
gegen E. cuniculi getestet. In den ersten 2 Monaten zeigten sieben Kaninchen
Anzeichen für die Entwicklung von Antikörpern gegen E. cuniculi und wurden sofort aus
der Kolonie entfernt. Die verbliebenen Kaninchen und ihre 52 Nachkommen wurden im
weiteren Verlauf negativ auf Antikörper getestet. Das heißt, mit entsprechenden Zucht-
und Hygienemaßnahmen wurde nach 16 Monaten ein E. cuniculi-freier Bestand
erreicht.
In einer weiteren Untersuchung von Cox & Gallichio, 1978 wurden Antikörper gegen E.
cuniculi mindestens zwei Wochen vor dem Nachweis intrazellulärer Sporen und vier
Wochen vor histopathologischen Läsionen oder Sporen im Urin nachgewiesen. Die
Ergebnisse zeigten auch, dass die Niere vor dem Gehirn infiziert war, was sowohl
durch die größere Anzahl und Schwere der histopathologischen Läsionen als auch
durch den Nachweis von Sporen in der Niere mehrere Wochen vor deren Nachweis im
Gehirn belegt werden konnte. Da im Urin keine Sporen bis vier Wochen nach Beginn
der Serum-Antikörper-Reaktion nachgewiesen werden konnten wurde vermutet, dass
von diesem Zeitpunkt an drei bis vier Wochen vergehen können, bis infizierte
Kaninchen in der Lage sind, die Infektion auf benachbarte Kaninchen zu übertragen.
Waller untersuchte 1979 in vitro (außerhalb eines lebenden Organismus) die
Empfindlichkeit von E. cuniculi gegenüber verschiedenen Temperaturen,
Desinfektionsmitteln und Medikamenten. Trockene Sporen überlebten mindestens 4
Wochen bei Raumtemperatur im Vergleich zu einer Woche im feuchten Zustand. Das
Gegenteil wurde bei einer Exposition bei 4°C beobachtet. Der Grund für diese
Abweichung im Verhalten der Sporen konnte nicht geklärt werden.
Koudela et al., 1999 evaluierten das Überleben von E.-cuniculi-Sporen in der Umwelt
an Mäusen. Es wurde kein merklicher Verlust der Infektiosität von Sporen festgestellt,
die zwei Jahre lang bei 4°C gelagert oder bei -12°C und -24°C für 1, 8 und 24 h
eingefroren wurden. Obwohl es nach dem Einfrieren bei -70°C einen bemerkenswerten
Verlust der Infektiosität gab, blieben die Sporen für bis zu 8 h infektiös. Die Ergebnisse
zeigten, dass E.cuniculi-Sporen Gefriertemperaturen überleben können, aber ihre
Infektiosität in Wasser verloren, das nach 5 Minuten eine Temperatur von 60°C
erreichte.
Bei Menschen mit AIDS (Acquired Immune Deficiency Syndrome = erworbenes
Immunschwächesyndrom) sind u. a. E. intestinalis und E. hellem die häufigsten
Krankheitsursachen und resultieren wahrscheinlich aus einer opportunistischen
Verbreitung der endogenen Mikroflora. Bei Menschen, die mit AIDS infiziert sind, wird
die intestinale Mikrosporidiose mit männlicher Homosexualität und Schwimmbädern in
Verbindung gebracht, was auf eine fäkal-orale Übertragung über sexuelle und
wassergebundene Wege hindeutet. Ein Bericht beschrieb andererseits ein 10jähriges
Mädchen, bei dem nach engem Kontakt mit einem infizierten Hundewelpen spezifische
Antikörper gegen E. cuniculi festgestellt wurden, in einem anderen Fall wurde eine
Übertragung von E. cuniculi und Enterocytozoon bieneusi auf einen Hundeführer
vermutet und in einem weiteren Fall eine Übertragung von Enterocytozoon bieneusi auf
ein Kind durch ein Meerschweinchen. Es gibt keine direkten Beweise dafür, dass
Hunde Menschen mit Mikrosporidien infizieren oder dass Menschen Hunde infizieren.
Isolate von E. cuniculi, Stamm III wurden bei Hunden und immungeschwächten
Personen identifiziert, was darauf schließen lässt, dass diese Spezies ein zoonotisches
Potenzial aufweist, eine häufige Expositionsquelle ist oder beides (Didier et al, 2012).
Als Hauptübertragungsweg des Parasiten bei Kaninchen wird die orale Aufnahme von
Futter angesehen, welches mit Urin der Tiere kontaminiert ist. Die Übertragung kann
auch durch infizierte Mäuse und Ratten erfolgen, die auf gelagerte Futtermittel
urinieren. Zum Teil wird auch eine mögliche Infektion über die Nase sowie den Augen
angenommen. Letztere wäre z. B. durch das Verspritzen von Urin gegeben. Durch eine
künstliche Infektion mittels Gabe von Sporen in den Bindehautsack konnten Tiere
infiziert werden (Jeklova et al., 2010b).
In einer Untersuchung von Ozkan et al., 2019 wurden nativ mit Parasitensporen
infizierte weibliche Kaninchen mit nicht infizierten Rammlern gepaart. Parasitäre DNA
in den Augen der Nachkommen wurde bei 6 von 11 natürlich seropositiven
Mutterkaninchen nachgewiesen (54 %). Die PCR-Ergebnisse waren in den Augen von
63 % (19/30) der Nachkommen von seropositiven Kaninchen positiv. Somit zeigten
Weibchen, die auf natürliche Weise mit E. cuniculi infiziert waren, die molekulare
Präsenz des Parasiten in den Augen ihrer Nachkommen. Die Sequenzanalyse
bestätigte die partiellen DNA-Sequenzdaten von E. cuniculi und die Blast-Analyse
identifizierte den Erreger als Genotyp I. Diese Ergebnisse bestätigen die Übertragung
von E. cuniculi auf die Augen der Kaninchennachkommen während der intrauterinen
Periode.
Vorkommen bei Wild- und Hauskaninchen
Wilson untersuchte 1979 drei junge Wildkaninchen, die in der Nähe von Edinburgh,
Schottland gefangen wurden und einen Fuchs auf das Vorhandensein von E. cuniculi.
Bei allen Tieren konnten Antikörper nachgewiesen werden. Im Fall des Fuchses war es
der erste Nachweis, der nicht nur zeigte, dass E. cuniculi die Nahrungskette von
Kaninchen über den oralen Weg zu ihren Fressfeinden hochsteigen kann, sondern
könnte auch der erste aufgezeichnete, subklinische Fall von Encephalitozoonose bei
einem Raubtier sein.
Cox & Ross, 1980 konnten in den Seren von 175 Wildkaninchen, die über zwei Jahre
in England und Schottland gefangen wurden, keine Antikörper gegen E. cuniculi finden,
woraus sie schlussfolgerten, dass dieser häufige „Laborkaninchenerreger“ bei
Wildkaninchen in diesen Gebieten selten sei.
Chalupský et al., 1990 untersuchten Seren von Wildkaninchen aus 4 verschiedenen
Populationen (jeweils zwei aus Île-de-France und Südfrankreich) mittels
Immunfluoreszenz auf das Vorhandensein von Antikörpern gegen E. cuniculi und
Toxoplasma gondii. 11 (5,9%) von 187 Seren waren positiv für T. gondii und 8 (3,8%)
von 204 waren positiv für E. cuniculi. Coelho et al., 2020 ermittelten eine Prävalenz von
67,9% für das Vorhandensein von T. gondii bei Wildkaninchen in Portugal. Bei T. gondii
handelt es sich ebenfalls um einen parasitären Einzeller, dessen Endwirt Katzen sind
und bei ihnen die zoonotische Toxoplasmose verursacht.
Meyer-Breckwoldt konnte in seiner Dissertation 1996 bei insgesamt 100 Wildkaninchen
keine Antikörper gegen E. cuniculi nachweisen. Die untersuchten Tiere stammten aus
dem Raum Hannover, Wolfsburg, nördlich von Hamburg sowie der Insel Norderney.
In einer Studie Gannon, 1980 wurden u. a. 7 verschiedene Populationen von
Hauskaninchen (kommerziell, privat) untersucht. In 6 von diesen wurden Antikörper
gegen E. cuniculi mit einer Prävalenz von 25-96% gefunden. Die höchste Infektionsrate
stammte aus einer Haltung mit einer Überbelegung von Kaninchen und einer hohen
Urinkontamination. Die Altersgruppe der Kaninchen mit dem höchsten Anteil ohne Titer
war 2-8 Monate alt, was darauf hindeutete, dass es sich bei einer Mehrzahl der
Infektionen um horizontale Kreuzkontaminationen zwischen den Kaninchen handelte.
Die einzige, seronegativ getestete Gruppe war eine speziell keimfrei gezüchtete
Kolonie, die unter strengen Hygienebestimmungen gehalten wurde.
Eine Untersuchung von Lev, 1982 erbrachte in Deutschland in zwei kommerziellen
Kaninchenzuchten 4,7% bzw. 10,2% und bei insgesamt 14 Kleintierzuchten 5,6%
seropositive Nachweise von E. cuniculi.
In dem Literaturüberblick seiner Dissertation zitierte Meyer-Breckwoldt, 1996
verschiedene Untersuchungsergebnisse mit Durchseuchungsgraden bei
Hauskaninchen von 10,2%-95%.
Harcourt-Brown und Holloway, 2003 stellten Ergebnisse serologischer Tests auf E.
cuniculi von 125 Hauskaninchen vor, die in einer Tierarztpraxis in England untersucht
wurden. Die Blutproben wurden von 38 asymptomatischen Kaninchen und 87
Kaninchen mit neurologischen, renalen oder okulären Anzeichen, die auf eine
Encephalitozoonose hindeuteten, entnommen. In der asymptomatischen Gruppe
waren sechs von 26 (23%) scheinbar gesunden Kaninchen, die im Rahmen eines
Gesundheitsscreenings beprobt wurden, seropositiv; von den übrigen 12
asymptomatischen Kaninchen, die beprobt wurden, weil sie mit seropositiven
Artgenossen zusammenlebten, waren acht (66%) seropositiv. 58 der Kaninchen mit
klinischer Erkrankung zeigten neurologische Anzeichen wie Kopfschiefhaltung (Head
tilt, Torticollis), Krampfanfälle, Ataxie und Schwanken/Schaukeln; drei von ihnen
Nierenerkrankungen und zwei okuläre Probleme - alle fünf Kaninchen waren
seropositiv. Kopfschiefhaltung war das häufigste neurologische Symptom in 21 von 23
(91%) der seropositiven Fälle. Alle neun Kaninchen mit okulären Läsionen waren
seropositiv und einige Fälle erholten sich ohne Behandlung.
Dipinito et al., 2008 sammelten in Süditalien zufällige Untersuchungsergebnisse aus
verschiedenen Arztpraxen von 47 Kaninchen ohne Symptome für EC und 78 Proben
von Kaninchen mit klinischen Symptomen. In 67% (84/125) der Kaninchen wurden
Antikörper gegen E. cuniculi nachgewiesen. Kaninchen mit einem Alter von > 4
Monaten waren unter diesen mit einem Anteil von 97% vertreten. Eine große Zahl der
seropositiven Tiere zeigten Läsionen in den Augen, neurologische Ausfälle und
Nierenerkrankungen.
Levytska, 2017 stellte Daten von 2563 Kaninchen vor, die unter verschiedenen
Bedingungen zwischen 2013-2016 in der Ukraine gehalten wurden. Die
Enzephalitozoonose manifestierte sich asymptomatisch, akut und chronisch. Der
asymptomatische Verlauf war der häufigste. Klinisch zeigte sich die Erkrankung als
schwere Nervenstörung wie durch den Ausfall der Sehorgane und des Harnsystems.
Insgesamt waren durchschnittlich 34 % der Population infiziert. Die Krankheit konnte
über das gesamte Jahr beobachtet werden, wobei die wenigsten im Frühling und
Sommer zu finden waren. Ein allmählicher Anstieg der Zahl erkrankter Tiere wurde im
Herbst beobachtet, der seine maximale Ausdehnung in der Wintersaison erfuhr.
Symptome
Lev, 1982 beschrieb die Encephalitozoonose als eine der am meisten verbreiteten
Infektionen bei Versuchstieren, insbesondere der Kaninchen. In der Regel verliefe
diese inapparent bzw. chronisch und bliebe unbemerkt. In einigen Fällen aus der
Literatur wurden klinisch mehr oder weniger leichte neurologische Störungen, wie
Teilparese der Gesichtspartien, schiefe Kopfhaltung, Blindheit, erhöhte Aggressivität,
Anorexie oder Polydipsie und nur vereinzelt schwerere Symptome wie
Encephalomyelitis (Multiple Sklerose) berichtet.
Wie bei (Labor-)Kaninchen, scheint die Krankheit bei wildlebenden Hasentieren in den
meisten Fällen subklinisch zu verlaufen, wobei ihre Auswirkungen auf die Gesundheit
der Kaninchen oft erst dann wichtig werden, wenn andere Belastungen (pathologisch,
metabolisch oder umweltbedingt) offensichtlich werden (Wilson, 1979; Chalupský et al.,
1990).
Eine Infektion mit E. cuniculi muss nicht zwangsläufig zu einer Erkrankung führen.
Diese äußert sich in ihrer akuten Form mit Opisthotonus, Torticollis, Hyperästhesie,
Paresen und Paralysen (Cox et al. 1972) und ist dann nicht selten mit einer hohen
Sterblichkeit verbunden.
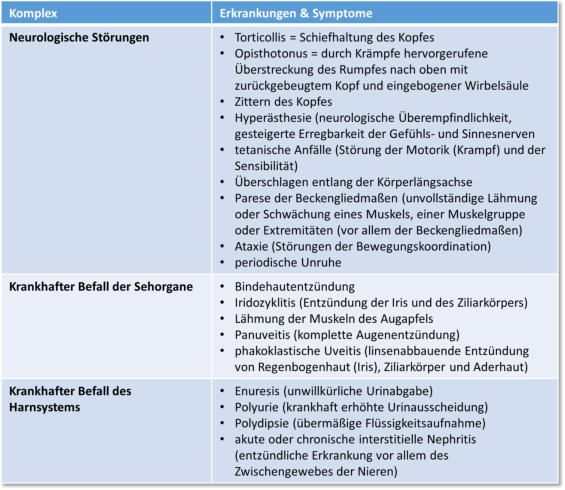
Die Enzephalitozoonose kann asymptomatisch, akut und chronisch auftreten, wobei
der häufigste Fall der asymptomatische ist. Nach Levytska et al., 2017 können die
Symptome in drei Komplexe eingeteilt werden. Die folgende Tabelle liefert einen
Überblick über Symptome der Encephalitozoonose, wie sie im Fall einer akuten oder
chronischen Erkrankung auftreten können.
Tabelle 2: Krankheitssymptome bei Kaninchen, nach Cox et al., 1972 & Levytska et al.,
2017
Differentialdiagnostisch müssen beim Auftreten einer Torticollis vor allem Erkrankungen
wie Ohrräude, Pasteurellose, Toxoplasmose sowie Otitis media (Mittelohrentzündung)
in Betracht gezogen werden.
Wenig Beachtung findet bis heute die Möglichkeit von Infektionen, die durch Zecken
(Ixodida) verursacht werden können. Zu den Erregern, die von Zecken übetragen
werden, gehören Ehrlichia spp., Borrelia spp., Francisella tularensis (Hasenpest),
Hepatozoon spp., Rickettsia spp., Cytauxzoon felis, Anaplasma phagocytophilum,
Babesia spp., Bartonella hensela (Greene et al., 2008) und Toxoplasma gondii (Dubey
& Lappin, 2008). Willy Burgdorfer, 1982 entdeckte das Bakterium Borellia burgdorferi
als Erreger der Lyme-Borreliose und stellte u. a. fest, dass Hauskaninchen für die
Erreger der Lyme-Borreliose empfänglich sind. Moody et al., 1990 konstatierten bei,
mit Borrelia burgdorferi infizierten, 3 Wochen alten Holländerkaninchen
multisystemische Infektionen sowie Arthritis und Karditis (entzündliche
Herzerkrankung). Die Lyme-Borreliose verläuft nach der Infektion in verschiedenen
Stadien. Im zweiten Stadium, welches Monate nach der Infektion beginnen kann,
gehören Karditis sowie die sog. Neuroborreliose mit häufiger Beteiligung der
Hirnnerven und meist mit akuter, peripherer Fazialislähmung. Im 3. Stadium (Monate
bis Jahre nach der Infektion) kann es zu Arthritis (Lyme-Arthritis) kommen und
schließlich zu Hirnnervenausfällen, akute Ataxie, akute Hemiplegie (Lähmung einer
Körperhälfte), Myelitis (Rückenmarksentzündung) sowie zu enzephalitischen
Prozessen (Pschyrembel, 2002)
Immunologie
Faktoren für eine Erkrankung
Bei immunkompetenten Kaninchen existiert ein immunologisches Gleichgewicht
zwischen dem parasitären Erreger und seinem Wirt. Einfach formuliert heißt das, dass
ein Parasit einen Organismus für seine eigene Existenz benötigt und deshalb kein
„Interesse“ daran hat, ihn zu zerstören. Erst eine Schwäche des Wirtes ermöglicht eine
übermäßige Vermehrung und somit den Ausbruch einer Erkrankung. Eine Infektion mit
E.-cuniculi an sich scheint aber auch einen immunsupprimierenden Effekt zu haben.
So leiden Kaninchen mit Antikörpern gegen E. cuniculi häufiger an zusätzlichen
Krankheiten als Tiere ohne Antikörper (Meyer-Breckwoldt, 1996). Bei Kaninchen gilt
„Stress“ als ein Hauptfaktor dafür, dass eine Infektion mit dem Parasiten E. cuniculi
zum Ausbruch der Erkrankung „Encephalitozoonose“ führt. Als Stressoren, die das
immunologische Gleichgewicht zwischen Parasit und Wirt negativ verändern können,
gelten z. B. (Homeier, 2005; Sieg, 2014; Rühle, 2019a, 2019b, 2019c):
•
schlechte Haltungsbedingungen,
•
Zugluft,
•
Standortveränderungen (in der Haltung vor Ort),
•
Transporte
•
Tod eines anderen Tieres im Haushalt
•
eine zusätzliche Krankheit,
•
Rangordnungskämpfe/Gruppenstress,
•
Vergesellschaftungen einander fremder Tiere,
•
Nährstoffmangel.
Infekionsdynamik
Lev, 1982 ermittelte die Dynamik der humoralen Immunantwort bei intravenös
infizierten Tieren. Den Beginn bildeten Immunglobuline der Klasse M (IgM) zwischen
dem 17.-20. Tag und einem Abklingen spätestens am 41. Tag. Die ersten Antikörper
IgG wurden zwischen dem 20.-31. Tag ermittelt und blieben bis nach dem 68. Tag
nachweisbar. Während der gesamten Zeit der Infektion waren bei keinem Tier klinische
Symptome nachzuweisen. Es zeigten sich große individuelle Unterschiede in der
Dynamik der humoralen Antikörperantwort, wie sie auch schon in anderen Arbeiten
konstatiert wurden. Bestätigt wurden frühere Vorschläge von Wissenschaftlern, dass
die IgM zeitlich am Anfang einer Infektion mit E. cuniculi bzw. der Immunantwort liegen
und früher absinken als die IgG.
Jeklova et al., 2010b untersuchten die experimentelle Infektion mit E. cuniculi über das
Auge als mögliche Folge des Verspritzens von Urin im Vergleich zur peroralen
Infektion. IgM konnten eine Woche nach der Infektion festgestellt werden, IgG folgten
eine weitere Woche später. Sporen im Urin und eine antigenspezifische, zellvermittelte
Immunantwort ließen sich 4-5 Wochen nach der Infektion nachweisen. Die
Immunreaktionen waren abhängig von der verabreichten Sporendosis. Klinische
Symptome traten erst nach der Verabreichung eines immunsupprimierenden
Medikaments auf. Die Konzentration maternaler Antikörper bei Jungtieren infizierter
Muttertiere sank ab der vierten Woche bis zu einem Alter von ca. 6 Wochen auf Null.
Daraus wurde gefolgert, dass ein gestiegener Antikörpernachweis mit der 8.
Lebenswoche auf eine akute, frische Infektion durch den Kontakt mit der infizierten
Mutter oder anderen infizierten (Jung-)Tieren zurückzuführen war.
Das Vorhandensein von IgM-Antikörpern ist somit ein Indikator für eine aktive Infektion.
Das Vorhandensein von nur IgG-spezifischen Antikörpern zeigt dagegen eine
chronische bzw. latente Infektion an.
Fortsetzung

Kaninchen würden Wiese kaufen



© A. Rühle: 2008-2023
© A. Rühle: 2008-2024



























































